Лечение рака груди: что нужно знать в 2018 году
Содержание статьи
Новости онкологии
08.06.2020
Жуков Николай Владимирович
Руководитель отдела междисциплинарной онкологии
ФГБУ «НМИЦ Детской гематологии, онкологии и иммунологии им. Д.Рогачева»,
доцент кафедры онкологии, гематологии и лучевой терапии
РНИМУ им. Н.И. Пирогова, доктор медицинских наук,
Москва
Нельзя сказать, что текущая сессия ASCO порадовала большим количеством знаковых и запоминающихся новостей в области лечения рака молочной железы. Из тем, выбранных для освещения в рамках доклада highlights of the day (основные моменты дня), наиболее важными и интересными нам показались следующие.
При метастатическом РМЖ (мРМЖ)
Исследование KEYNOTE-355 по оценке эффективности и безопасности пембролизумаба в комбинации с химиотерапией по выбору врача в качестве первой линии лечения распространенного трижды-негативного рака молочной железы (ТН РМЖ). Да, это большое (n=847), хорошо организованное и доказательное исследование, которое, скорее всего, приведет к регистрации и появлению в нашем арсенале еще одного (кроме атезолизумаба) ингибитора контрольных точек иммунитета, зарегистрированного для лечения распространенного ТН РМЖ. С небольшими «девиациями» в отношении способа применения — атезолизумаб испытывался и зарегистрирован в комбинации только с одним цитостатиком (наб-паклитаксел), а пембролизумаб дает возможность выбора партнера; для атезолизумаба точкой «отсечения» является экспрессия PD-L1 CPS ≥1, для пебролизумаба CPS ≥10 (38% больных от включенных в исследование). Также необходимо отметить, что в исследованиях для оценки статуса PD-L1 использовались разные клоны антител. Но, к сожалению, в целом, как и для атезолизумаба ранее, нельзя сказать, что пембролизумаб совершил чудо в лечении ТН РМЖ — плюс 4 месяца к медиане (9,7 vs 5,6 мес.) и примерно +10% (≈30 vvs ≈20%) к 2-летней выживаемости без прогрессирования, без данных об увеличении общей выживаемости. Да, для опухоли, при которой испытывается явный и многолетний дефицит лечебных опций, и это неплохо, но не более того (несопоставимо с выигрышем, получаемым при многих других нозологиях).
К нашему большому сожалению, пришли негативные результаты исследования, посвященного роли эндокринного компонента в комбинации с CDK4/6 ингибиторами. Этот вопрос представлялся достаточно важным — если все CDK4/6 очень схожи в отношении эффективности, то может быть манипуляции со второй составляющей комбинации позволит еще больше улучшить результаты. Косвенные предпосылки к этому были — как исследование FALCON, свидетельствующее о большей эффективности фулвестранта по сравнению с ингибиторами ароматазы в качестве начальной моноэндокринотерапии, так и данные, полученные в исследовании MONALEESA-3, где комбинация фулвестранта с рибоциклибом позволила добиться в подгруппе больных с ранее нелеченным мРМЖ или поздним рецидивом (спустя >12 мес. после завершения адъювантной эндокринотерапии) ранее невиданной медианы выживаемости без прогрессирования в 33,6 мес. (против 25,3 мес. в исследовании MONALEESA-2, где в схожей популяции больных тот же рибоциклиб применялся в комбинации с ингибиторами ароматазы). Увы, результаты исследования II фазы (n=486), напрямую сравнивающего комбинацию палбоциклиба с летрозолом или фулвестрантом в качестве первой линии лечения мРМЖ, не показали преимуществ последнего (медиана выживаемости без прогрессирования 32,8 vs 27,9 мес. соответственно, р=0,321).
Пожалуй, единственной «прорывной» темой в отношении лечения мРМЖ на ASCO 2020, с нашей точки зрения, можно назвать обновленные результаты исследования HER2CLIMB. Во всяком случае, в части, посвященной лечению больных с метастазами в головной мозг. Данное исследование (n=612) оценивало эффективность и безопасность новой малой молекулы — селективного HER2-ингибитора тукатиниба — в комбинации с трастузумабом и капецитабином для лечения больных HER2-позитивным мРМЖ, ранее уже получивших трастузумаб, пертузумаб и T-DM1. Больные контрольной группы получали трастузумаб и капецитабин в комбинации с плацебо. Возможно, это было бы еще одним из исследований новой анти-HER2 молекулы, если бы не две особенности — в исследование включались больные не только с контролируемыми, но и с активными (прогрессирующими) метастазами в головной мозг, и исследование показало действительно клинически ощутимое преимущество новой терапии в этой подгруппе больных (медиана общей выживаемости в группе с активными метастазами в группе тукатиниба 20,7 мес. против 11,6 мес., одногодичная выживаемость 72 мес. vs 41 мес.). Отмечено в исследовании было и значимое снижение риска развития метастазов в головной мозг у больных, получавших тукатиниб и не имевших их исходно. Таким образом, очевидно, что в настоящий момент на вопрос — есть ли значимая роль лекарственного лечения при метастазах РМЖ в головной мозг, наконец-то можно дать утвердительный ответ.
При раннем РМЖ,
увы, также было больше разочарований. Во многом впечатленные результатами исследования KATHERINE, показавшего, что T-DM1 в адъювантном режиме в состоянии «исправить» прогноз больных HER2-позитивным РМЖ, не ответивших полной патоморфологической ремиссией на неоадъювантную трастузумаб-содержащую терапию, мы с нетерпением ждали результатов исследования KAITLIN (n=1846), в котором сравнивалась эффективность комбинации T-DM1/пертузумаб и трастузумаб/пертузумаб/таксаны у больных, завершивших адъювантную антрациклин-содержащую терапию. Увы, на этот раз чуда не произошло: выживаемость, свободная от инвазивного РМЖ — IDFS (первичная цель исследования), оказалась очень высокой, но почти неотличимой в обеих группах (3-летняя IDFS в группе Т-DM1 92,8% vs 94,1% в контрольной группе, р=0,827). И хотя исследователи сообщили о более высоком качестве жизни в группе T-DM1, возможно, это было обусловлено тем, что значимо больше пациентов, получавших T-DM1, досрочно завершили лечение в связи с токсичностью (27% против 4% в контрольной группе). Так что данное исследование оказалось ближе не к «победоносному» KATHERINE, а к другому негативному исследованию по использованию T-DM1 при раннем РМЖ (исследование KRISTINE, не показавшее преимущества неоадъювантной терапии T-DM1/пертузумаб/химиотерапия vs трастузумаб/пертузумаб/химиотерапия). Правда, исследование KATHERINE принесло на ASCO 2020 весьма интересную с нашей точки зрения, хотя и не вошедшую в сессию highlights, информацию. В рамках конгресса были доложены результаты анализа молекулярных маркеров и их влияния на результаты лечения в рамках исследования. Интересной особенностью исследования являлось то, что анализу на молекулярные маркеры подвергалась не первичная опухоль, а хирургические образцы, полученные после неоадъювантной терапии (за исключением ≈20% больных, у которых были доступны только образцы, полученные до начала лечения). При этом авторами было отмечено, что уровень экспрессии HER2 претерпел значимое снижение в процессе неоадъювантной терапии (р<0,001), в то время как уровень остальных анализируемых маркеров, включая и «иммунные» характеристики — экспрессия PD-L1 и т.д., не изменился. Весьма неожиданным оказалось, что наличие мутации PIK3CA, которая большинством исследователей признается неблагоприятным прогностическим признаком вне зависимости от подтипа РМЖ, не оказало никакого влияния на прогноз больных и результаты лечения, в то время как низкая экспрессия PD-L1 и HER2 на прогноз и результаты лечения влияли, но весьма интересным образом. Низкая экспрессия PD-L1 и HER2 значимо (действительно значимо — АБСОЛЮТНЫЕ различия достигали ≈30%) снижала IDFS, но только в группе, получавшей в адъювантном режиме трастузумаб. Среди пациенток, получавших в адъювантном режиме T-DM1, выживаемость в зависимости от экспрессии PD-L1 и HER2 не различалась и была значимо выше, чем в группе трастузумаба. Увы, два других исследования, посвященные поиску прогностических/предсказательных факторов и возможности избежать назначения адъювантной химиотерапии (ограничившись лишь эндокринотерапией) при раннем люминальном РМЖ, хотя и вошли в highlights, но вряд ли применимы в нашей стране вследствие того, что используемые в них методы анализа неприменимы у нас.
Упоминания в highlights было удостоено еще одно из исследований — SYSUCC-01. Это исследование, правда опять на азиатской популяции (пришедшее к нам из Китая), дало подтверждение потенциальной эффективности дополнительной терапии капецитабином у больных ранним РМЖ, завершивших основную часть (нео)адъювантной терапии. В этом исследовании больные Ib-IIIc стадиями ТН РМЖ (n=443), закончившие стандартную нео(адъювантную) терапию с включением антрациклинов и/или таксанов, рандомизировались на метрономную терапию капецитабином (650 мг/м2 2 раза в сутки, непрерывно, в течение года) или наблюдение. По данным исследователей, использование капецитабина при вполне переносимой токсичности (до конца свой капецитабин «допили» 91% пациенток, 74% — без редукции дозы и интервалов) привело к увеличению 5-летней выживаемости без прогрессирования с 73% до 83% (р=0,027) и тенденции к увеличению общей выживаемости. Пожалуй, единственным фактором, который в настоящий момент останавливает нас от использования «продленного адъюванта» капецитабином (в том или ином виде) при РМЖ, является качество (и токсичность) доступных в РФ препаратов с этим МНН.
А вот вопрос в отношении роли антрациклинов при HER2-позитивном раннем РМЖ становится все более и более напряженным. Эти препараты, на протяжении многих лет являвшиеся основой (нео)адъювантной терапии при всех подтипах РМЖ, при HER2-позитивном раке, постепенно сдают свои позиции. Очередным негативным (для антрациклинов) исследованием явилось исследование TRAIN-2 (n=438), в котором сравнивалась эффективность неоадъювантной терапии 3 циклами FEC + 6 циклов карбоплатин/паклитаксел и 9 циклов карбоплатин/паклитаксел (обе группы параллельно со всеми циклами химиотерапии получали пертузумаб и трастузумаб) в лечении больных II-III стадией HER2+ РМЖ. В 2018 году в журнале Lancet были опубликованы результаты по частоте достижения полных патоморфологических ремиссий (первичная цель исследования), которая оказалась абсолютно идентична — 68% в группе, не получавшей антрациклины, и 67% в группе, получавшей их. В этом году на ASCO было показано, что и бессобытийная выживаемость никоим образом не улучшается от добавления антрациклинов (3-летняя выживаемость ≈93% в обеих группах). 3-летняя общая выживаемость в обеих группах составила около 98%.
Из того, что не вошло в highlights, но является с нашей точки зрения интересным, хотя и разочаровывающим, являются данные о том, что перенос CDK4/6 ингибиторов в лечение более ранних стадий люминального РМЖ не приносит таких же успехов, которые мы видим в лечении метастатической болезни. Хотя, стоит признать, что это как раз характерно для данного подтипа опухоли (исходя из опыта других препаратов). Но факт остается фактом, в пилотном исследовании FELINE (n=120) добавление рибоциклиба к летрозолу в рамках неоадъювантной эндокринотерапии люминального РМЖ не привело к значимому увеличению непосредственной эффективности ни в отношении объективного ответа, ни в отношении патоморфологического ответа (комбинированный показатель PEPI). В группах, получавших рибоциклиб, при биопсии, планово осуществлявшейся на 14 день лечения, отмечалась значимо большая частота полного клеточного ареста (ki-67<2,7%), однако к моменту выполнения хирургического лечения у многих больных, получавших рибоциклиб, уровень ki-67 вновь нарос, и доля больных с полным клеточным арестом в опухоли сравнялась в обеих группах. Да, в данном случае речь идет о пилотном исследовании, не оценивающем отдаленные результаты лечения и использующем суррогатные конечные точки. Однако вкупе с недавно опубликованным (вне рамок конгресса ASCO) пресс-релизом о том, что исследование PALLAS, оценивающее эффективность и безопасность палбоциклиба в адъювантном режиме, вряд ли достигнет своей первичной цели — увеличения IDFS при ранних стадиях люминального РМЖ, перспектива CDK4/6 в этой области выглядит уже не столь радужной.
Источник: конгресс ASCO (сессия РМЖ, сессия РМЖ — лучшее).
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Источник
Лечение рака груди: что нужно знать в 2018 году
О том, что такое рак груди, происхождении и симптомах заболевания написано немало: и в глянцевых журналах, и в серьезных медицинских изданиях. И лечение рака груди освещено неплохо. Вот только любая информация имеет свойство устаревать по мере прогресса. Тем более по такой важной в мировом масштабе теме, как рак груди. Необходимо восполнить этот «пробел».
О том, какие возможности имеет современная медицина, чтобы сделать лечение рака груди более эффективным и менее травмирующим (как с физиологической, так и с психологической точки зрения), и том, какие из описанных возможностей уже сегодня предлагает Онкологическая клиника МИБС для жителей России и других стран, — наш материал.
Возможно ли лечение рака груди без операции?
Судя по вопросам пациентов, обращающихся с запросами о возможности лечения рака молочной железы в Онкологической клинике МИБС, многих из них пугает необходимость проведения хирургического удаления опухоли. Вынуждены сообщить — несмотря на развитие лучевых методов лечения рака без операции (большинство из которых доступны в России в нашей онкологической клинике) ни протонная терапия, ни радиохирургия на КиберНоже, ни высокоточная лучевая терапия не способны полностью заменить хирургическое лечение.
Но есть прогресс и в данном направлении.
Во-первых, хирургическое лечение рака груди сегодня является лишь частью комбинированного подхода. Отвечая на потребности сообщества пациентов, мировая онкология определила наиболее эффективную форму онкологической помощи. Она включает междисциплинарный подход к лечению, при котором междисциплинарный консилиум (tumor board), состоящий из врачей различных специальностей (клинический онколог, хирург, химиотерапевт. лучевой терапевт и др.), совместно определяет тактику лечения, что исключает несовместимость назначений, а также позволяет не только эффективно бороться с опухолью и ее метастазами, но и обеспечить максимальное качество жизни пациента как во время лечения, так и после его завершения.

Ни протонная терапия, ни радиохирургия на КиберНоже, ни высокоточная лучевая терапия не способны полностью заменить хирургическое лечение рака груди
Во-вторых, благодаря собственной морфологической лаборатории МИБС, пациентам предлагается иммуногистохимия, исследование образца опухоли с целью поиска возможных уязвимостей перед действием таргетных препаратов, влияющих на эти специфические мутации клеток опухоли, или выявления отсутствия «защитного механизма» конкретного типа рака молочной железы перед специфическим иммунитетом, который может «включить» иммунотерапия.
Собственная морфологическая лаборатория (Центр морфологической диагностики МИБС) — это возможность не только пройти иммуногистохимическое исследование образцов опухоли, но и:
- получить точный ответ о злокачественности / доброкачественности опухоли молочной железы (и, таким образом, получить шанс избежать лечения при ошибке в первичной диагностике, проведенной в другом мед.учреждении);
- провести верификацию опухоли, точно определив ее тип, что позволит оптимизировать тактику лечения.
Хирургическое лечение рака груди — что нового?
Увы, но пока иммунотерапия и таргетное лечение подходят единицам из тысяч пациенток с диагнозом «рак груди». Поэтому современные мировые протоколы оказания онкологической помощи (лечение рака груди по которым ведется и в Онкологической клинике МИБС) предусматривают проведение хирургического вмешательства с целью удаления первичной опухоли и части лимфоузлов, в которые, вероятно, распространились злокачественные клетки.
Однако хирургическое лечение рака груди в МИБС далеко от тех ассоциаций, которые всплывают в подсознании, когда мы слышим термин «хирургия». Если рак груди выявлен на ранней стадии, современные методики органосохраняющей хирургии не только позволяют обойтись без полного удаления молочной железы (тотальная мастэктомия), но и дают возможность удалять небольшие опухоли без последующих косметических дефектов и без необходимости пластической реконструкции.
И даже при более крупных опухолях выполняемая операция будет направлена не только на удаление опухоли, но и на сохранение внешнего вида, как за счет одномоментной пластической коррекции, выполняемой во время операции, так и за счет последующей пластической реконструкции, основа которой закладывается во время основного вмешательства.
Комбинированное лечение рака груди: этап химиотерапии и «облучения» (лучевого лечения)
После проведения хирургического удаления рака молочной железы наступают не менее ответственные этапы. О высокоточной лучевой терапии, в которой специалисты и оборудование Онкологической клиники МИБС являются одними из лучших в России, Вы, наверняка слышали. И с годами наши позиции только усиливаются благодаря повышению квалификации лучевых терапевтов и медицинских физиков, а также за счет модернизации технического и программного обеспечения.
А вот обязательная в большинстве случаев химиотерапия — лечение рака груди путем системного воздействия на весь организм с целью разрушения циркулирующих в организме микрочастиц первичной опухоли (метастазы рака груди, либо метастатический рак молочной железы), — проводимая в Онкологической клинике МИБС, требует особого внимания.
Наше отделение химиотерапии делает все как для достижения максимального эффекта в борьбе с раком молочной железы (остановка роста либо деградация опухоли), так и для минимизации побочных эффектов химиотерапии.
Пациенты МИБС получают лечение рака груди, соответствующее современным стандартам:
- безопасное и точное приготовление (разведение) химиопрепаратов проводится согласно протоколу безопасности, что исключает ошибки в дозировке и назначениях;
- точная дозировка введения — каждому пациенту предоставляется инфузомат, специальное электронное устройство, через которое приготовленный химиопрепарат вводится с оптимальной скоростью;
- комфортность введения — через специальный «порт», устанавливаемый во время несложного хирургического вмешательства в отделении хирургии Онкологической клиники МИБС, вводимый препарат химиотерапии попадает непосредственно в магистральные кровеносные сосуды, что защищает периферические вены от постоянного травмирования при длительных курсах лечения.
Лечение метастатического рака груди
К сожалению, сосредоточившись на лечении первичного рака молочной железы, пациентки и даже их лечащие врачи не уделяют должного внимания возможному началу распространения метастазов из молочной железы в другие органы. Метастатический рак груди будет требовать коррекции избранной тактики лечения или полной ее смены. Лечение одиночных метастазов в Онкологической клинике МИБС может быть проведено, как хирургически, так и радиохирургически (КиберНож, Гамма-нож, высокоточный линейный ускоритель TrueBeam STx); множественные метастазы рака груди потребуют модификации схемы химиотерапии и т.д. Но первым шагом к лечению метастазов является их раннее обнаружение — в случае позднего выявления именно метастазы рака груди часто становятся причиной летального исхода.
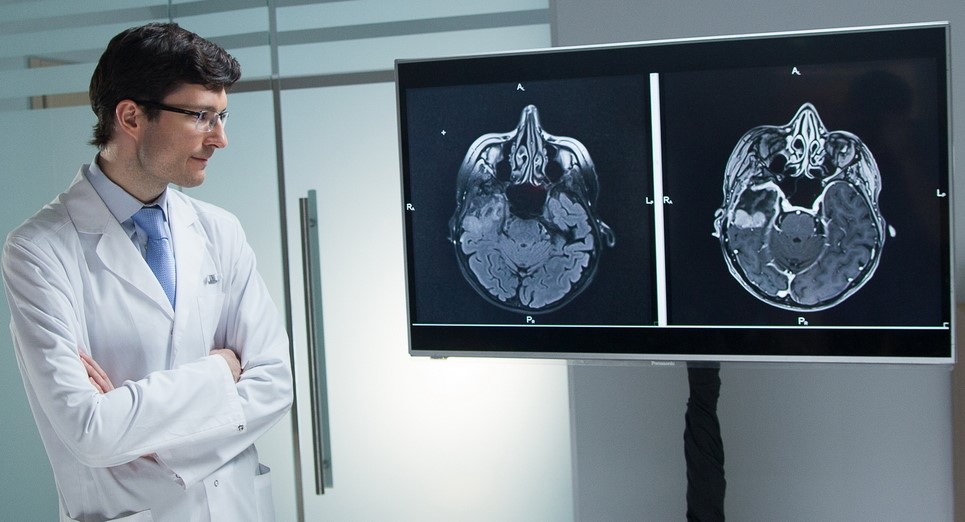
Метастазы рака груди в головной мозг — серьезное испытание как для пациентки, так и непростая задача для врача
Основные «мишени», в которых регистрируются метастазы рака груди, — это кости, легкие, головной мозг, печень. Каждую из этих локализаций лечащий врач может просто, безопасно и, что немаловажно, относительно недорого контролировать с целью раннего выявления метастазов.
Метастазы в кости
— один из самых сложных в лечении и диагностике видов метастатического рака груди. Однако, учитывая частоту распространения злокачественных опухолей молочной железы в кости, буквально первые симптомы метастатических поражений скелета (в первую очередь, неприятные ощущения, «ломота», в костях и неспровоцированные переломы) должны послужить сигналом к проведению доскональной диагностики.
В зависимости от клинического случая, для выявления метастазов рака груди в кости проводится МРТ всего тела, остеосцинтиграфия, КТ (зонально).
Метастазы рака груди в легкие
С поиском возможного распространения злокачественной опухоли молочной железы также отлично справляется позитронно-эмиссионная томография, что позволяет провести одновременное обследование костей и легкого. Отличную информативность предоставляет и компьютерная томография (КТ), но в таком случае, если планируется курс лучевой терапии первичной опухоли, врачу следует учитывать дополнительную лучевую нагрузку на организм — при КТ применяется иной вид ионизирующего излучения — рентгеновское.
Метастазы в печень
Несмотря на то, что метастазы рака груди в печень также отлично диагностируются на ПЭТ, проведение этого вида диагностики чаще всего оправдано при наличии симптомов. Однако и при их отсутствии у пациентки есть возможность контролировать вероятное метастазирование в печень — с помощью УЗИ. Ультразвуковое исследование на современных аппаратах экспертного класса поможет увидеть новообразования в печени, при этом стоимость такого «контроля» — невысока, а аппарат УЗИ есть едва ли не в любом из лечебных учреждений России.
Метастазы рака груди в головной мозг
Любые новообразования, в том числе, метастазы в головном мозге, выявляет МРТ с контрастом. При выполнении магнитно-резонансной томографии головного мозга с контрастом на современном томографе с напряженностью магнитного поля 1,5 Тесла и выше снимки достоверно покажут наличие и активность новообразований, что позволит не только определить опухоль, но и отличить вновь образовавшийся метастаз от того, что уже был пролечен с помощью радиохирургии и не проявляет биологической активности.
Метастазы рака груди и иммуногистохимия
Одной из особенностей метастатического рака является вероятность мутаций отдаленных метастазов относительно первичной опухоли. С точки зрения терапии — это свойство может привести к утрате метастазами специфических уязвимостей перед лечением таргетными препаратами и иммунотерапией. Поэтому пациентам, получающим таргетную терапию или иммунотерапию (если есть возможность выполнить биопсию метастаза) рекомендуем проведение иммуногистохимии для вероятной коррекции программы комплексной онкологической помощи.
Рак груди у мужчин
Современная статистика, все еще не демонстрирует положительной динамики в повышении выживаемости при раке груди у мужчин. Да, рак молочной железы угрожает и мужчинам, удивлены? Именно по причине недостаточной информированности общества мужчины, у которых проявляются даже явные симптомы рака молочной железы, не обращаются к профильному специалисту, а наблюдающие такого пациента врачи (обычно, терапевт или хирург по месту жительства) сами упускают возможность своевременной постановки диагноза «рак груди» ввиду крайней редкости данного вида рака у мужчин.
Лучшее лечение — раннее выявление
Лучший способ борьбы с раком любой локализации — это профилактика и раннее выявление. Несмотря на кажущуюся простоту подобного подхода, профилактические (скрининговые) обследования на предмет выявления опухолевых заболеваний у тех, кто не имеет никаких симптомов опухоли, по-прежнему демонстрируют высокие результаты.
Рак груди в данном аспекте — один из наиболее доступных для ранней диагностики. В составе современных «скрининговых» протоколов обязательно включена маммография — рентгенографическое исследование молочных желез. Недостатком такого метода является лучевая нагрузка на организм, из-за чего ежегодная маммография применяется в качестве базовой процедуры скрининга (в зависимости от страны) начиная с возраста 35-40 лет.
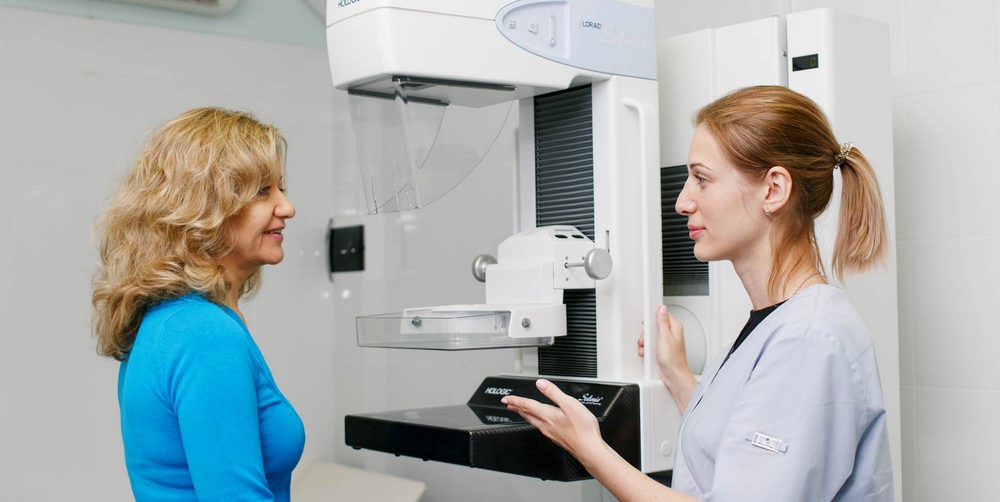
Маммография — традиционно эффективный метод скрининга рака груди
Тем, у кого повышенная вероятность встретится с таким диагнозом (например, при наличии в семейной истории рака), скрининг рака груди, до достижения «возраста маммографии», может включать УЗИ молочных желез и МРТ молочных желез. Первый метод — прост и дешев, и его целесообразно применять чаще, однако МРТ молочных желез обладает более высокой информативностью. По этой причине МРТ молочных желез — востребованная услуга во всех Диагностических центрах МИБС в России и за ее пределами.
Психолог и лечение рака груди
Не обязательный с точки зрения протоколов, но важный с точки зрения настроя пациентки и готовности пройти все испытания, компонент онкологической помощи, получающий все большее распространение в практике мировой онкологии. Учитывая насколько психологически тяжело пациентки воспринимают саму возможность хирургического лечения, психологическая служба Онкологической клиники МИБС ведет работу в соответствии с передовыми методиками и собственными наработками для того, чтобы мобилизовать все силы пациентки на борьбу с болезнью.
Реабилитация
Современная онкологическая помощь направлена не только на борьбу с раком, но и на сохранение качества жизни после завершения. Поэтому обязательным в современном процессе оказания онкологической помощи является создание базы для облегчения процесса реабилитации еще на этапе разработки тактики лечения конкретного пациента. Поэтому в Онкологической клинике МИБС на повестке заседания междисциплинарного консилиума в обязательном порядке рассматриваются вопросы реабилитации (исходя из состава запланированного лечения), а также обсуждаются меры по максимальному облегчению состояния пациента, исходя из индивидуальных особенностей клинического случая, а пациентам, заканчивающим лечение, выдаются персональные рекомендации.
Регулярный контроль
Наиболее желаемый эффект лечения достигнут — рак молочной железы побежден. Но на этом лечение не заканчивает. Задача врачей и психолога — обосновать и организовать прохождения

Источник